Transferência de energia de ressonância de fluorescência (FRET)
A transferência de energia por ressonância de fluorescência (FRET) é um processo de transferência de energia não radiativa no qual a energia do estado excitado do doador é transferida para o estado excitado do aceitador através da interação de pares elétricos intermoleculares.Este processo não envolve fótons e, portanto, não é radiativo.Este ensaio tem as vantagens de ser rápido, sensível e simples.
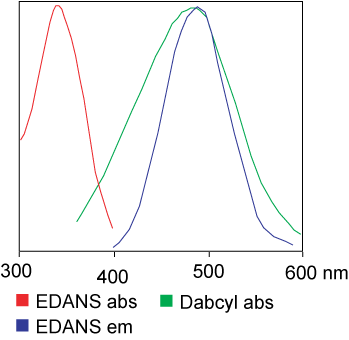
O corante utilizado no ensaio FRET pode ser idêntico.Mas na maioria das aplicações, diferentes corantes são usados.Resumidamente, a transferência de energia de ressonância luminosa é a transferência de um par de dipolos do doador (corante 1) para o aceitador (corante 2) quando o grupo doador está excitado.Em geral, o espectro de emissão do grupo fluoróforo Doador se sobrepõe ao espectro de absorção do grupo Aceitador.“Quando a distância entre os dois fluoróforos é apropriada (10 – 100 A), a transferência de energia do fluoróforo do doador para o aceitador.”O método de transferência de energia depende da estrutura química do receptor:
1. É convertido em vibração molecular, ou seja, a luz luminosa da transferência de energia desaparece.(O receptor é um supressor de luz)
2. A emissão é mais intensa que o próprio receptor, resultando em um desvio para o vermelho no espectro de fluorescência secundária.”(Receptores são emissores luminosos).
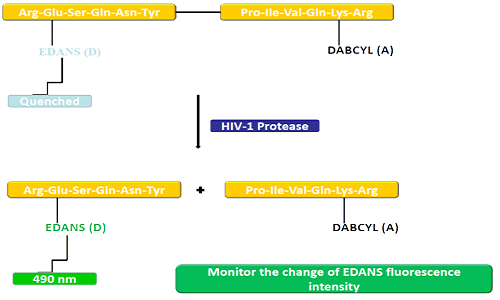
O grupo doador (EDANS) e o gene aceitador (DABCYL) estão uniformemente ligados ao substrato natural da protease do HIV e, quando o substrato não está desconectado, o DABCYL pode extinguir o EDANS e então tornar-se indetectável ao flúor.Após a desconexão da protease do HIV-1, o EDANS não é mais extinto pelo DABCYL e as luciferases do EDANS podem ser posteriormente detectadas.A disponibilidade de inibidores de protease pode ser monitorada por alterações na intensidade de fluorescência do EDANS.
Os peptídeos FRET são ferramentas convenientes para estudar a inespecificidade da peptidase.Uma vez que o seu processo de reacção pode ser continuamente monitorizado, proporciona um método conveniente para detectar a actividade enzimática.O brilho produzido após a hidrólise das ligações peptídicas pelo doador/aceitador fornece uma medida da atividade enzimática em concentrações nanomolares.Quando o peptídeo FRET está intacto, ele mostra um desaparecimento repentino do flash interno, mas quando qualquer ligação peptídica oposta ao doador/aceitador se rompe, ele libera um flash, que pode ser detectado continuamente e a atividade da enzima pode então ser quantificada.
Horário da postagem: 14 de agosto de 2023