Os peptídeos são uma classe de compostos formados pela conexão de múltiplos aminoácidos através de ligações peptídicas. Eles são onipresentes em organismos vivos. Até agora, dezenas de milhares de peptídeos foram encontrados em organismos vivos. Os peptídeos desempenham um papel importante na regulação das atividades funcionais de vários sistemas, órgãos, tecidos e células e nas atividades da vida, e são frequentemente usados em análise funcional, pesquisa de anticorpos, desenvolvimento de medicamentos e outros campos. Com o desenvolvimento da tecnologia de biotecnologia e síntese de peptídeos, mais e mais medicamentos peptídicos foram desenvolvidos e aplicados na clínica.
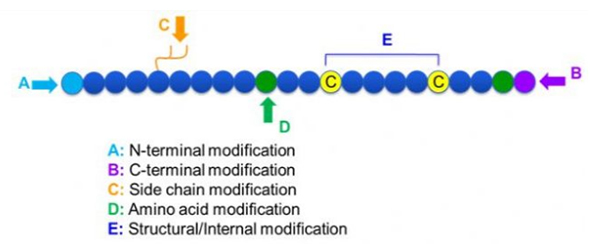
Há uma grande variedade de modificações peptídicas, que podem ser simplesmente divididas em modificação pós-modificação e processo (usando modificação derivada de aminoácidos) e modificação N-terminal, modificação C-terminal, modificação da cadeia lateral, modificação de aminoácidos, modificação do esqueleto etc., dependendo do local de modificação (Figura 1). Como um meio importante para alterar a estrutura principal da cadeia ou os grupos de cadeia lateral de cadeias peptídicas, a modificação de peptídeos pode efetivamente alterar as propriedades físicas e químicas dos compostos peptídicos, aumentar a solubilidade da água, prolongar o tempo de ação in vivo, mudar sua distribuição biológica, eliminar a imunogenicidade, reduzir os efeitos colaterais tóxicos, etc. Nesse artigo, várias principais modificações de módios de imunogação.
1. Ciclização
Os peptídeos cíclicos têm muitas aplicações na biomedicina, e muitos peptídeos naturais com atividade biológica são peptídeos cíclicos. Como os peptídeos cíclicos tendem a ser mais rígidos que os peptídeos lineares, eles são extremamente resistentes ao sistema digestivo, podem sobreviver no trato digestivo e exibir uma afinidade mais forte pelos receptores alvo. A ciclização é a maneira mais direta de sintetizar peptídeos cíclicos, especialmente para peptídeos com grande esqueleto estrutural. De acordo com o modo de ciclização, ele pode ser dividido no tipo de cadeia lateral da cadeia, Terminal - Tipo de cadeia lateral, Terminal - Tipo de terminal (tipo de extremidade a extremidade).
(1) Sidechain-to-Sidechain
O tipo mais comum de ciclização da cadeia lateral a lateral é a ponte dissulfeto entre os resíduos de cisteína. Essa ciclização é introduzida por um par de resíduos de cisteína sendo desprotegidos e depois oxidados para formar ligações dissulfeto. A síntese policíclica pode ser alcançada pela remoção seletiva de grupos de proteção de sulfidril. A ciclização pode ser feita em um solvente pós-dissociação ou em uma resina pré-dissociação. A ciclização em resinas pode ser menos eficaz que a ciclização do solvente, porque os peptídeos em resinas não formam facilmente conformações ciclificadas. Outro tipo de ciclização da cadeia lateral - é a formação de uma estrutura amida entre um ácido aspártico ou resíduo de ácido glutâmico e o aminoácido base, o que exige que o grupo de proteção da cadeia lateral deva ser removido seletivamente do polipeptídeo na resina ou após a dissociação. O terceiro tipo de ciclização da cadeia lateral-é a formação de éteres de difenil por tirosina ou p-hidroxifenilglicina. Esse tipo de ciclização em produtos naturais é encontrado apenas em produtos microbianos, e os produtos de ciclização geralmente têm um valor medicinal em potencial. A preparação desses compostos requer condições únicas de reação, portanto, elas não são frequentemente usadas na síntese de peptídeos convencionais.

(2) Terminal para Sidechain
A ciclização da cadeia do lado terminal geralmente envolve o terminal C com o grupo amino da cadeia lateral lisina ou ornitina, ou o terminal N com o ácido aspártico ou a cadeia lateral do ácido glutâmico. Outra ciclização do polipeptídeo é feita pela formação de ligações éter entre as cadeias laterais do terminal C e de serina ou treonina.
(3) tipo de terminal ou de cabeça à cauda
Os polipeptídeos da cadeia podem ser ciclados em um solvente ou fixados em uma resina por ciclação da cadeia lateral. Baixas concentrações de peptídeos devem ser usadas na centralização do solvente para evitar a oligomerização dos peptídeos. O rendimento de um polipeptídeo sintético da cabeça a cauda depende da sequência do polipeptídeo da cadeia. Portanto, antes de preparar peptídeos cíclicos em larga escala, uma biblioteca de possíveis peptídeos de chumbo encadeada deve ser criada primeiro, seguida de ciclização para encontrar a sequência com os melhores resultados.
2. N-metilação
A n-metilação ocorre originalmente em peptídeos naturais e é introduzida na síntese de peptídeos para impedir a formação de ligações de hidrogênio, tornando assim os peptídeos mais resistentes à biodegradação e à depuração. A síntese de peptídeos usando derivados de aminoácidos N-metilados é o método mais importante. Além disso, a reação de mitsunobu de intermediários de polipeptídeo-resina de n-nitrobenzeno sulfonil) também pode ser usada. Este método foi usado para preparar bibliotecas de peptídeos cíclicas contendo aminoácidos N-metilados.
3. Fosforilação
A fosforilação é uma das modificações pós-traducionais mais comuns na natureza. Nas células humanas, mais de 30% das proteínas são fosforiladas. A fosforilação, especialmente a fosforilação reversível, desempenha um papel importante no controle de muitos processos celulares, como transdução de sinal, expressão gênica, ciclo celular e regulação do citoesqueleto e apoptose.
A fosforilação pode ser observada em uma variedade de resíduos de aminoácidos, mas os alvos de fosforilação mais comuns são os resíduos de serina, treonina e tirosina. Os derivados de fosfotirosina, fosfotreonina e fosfoserina podem ser introduzidos em peptídeos durante a síntese ou formados após a síntese do peptídeo. A fosforilação seletiva pode ser alcançada usando resíduos de serina, treonina e tirosina que removem seletivamente grupos de proteção. Alguns reagentes de fosforilação também podem introduzir grupos de ácido fosfórico no polipeptídeo por pós -modificação. Nos últimos anos, a fosforilação da lisina específica do local foi alcançada usando uma reação quimicamente seletiva de Staudinger-fosfita (Figura 3).

4. Miristoilação e palmitoilação
A acilação do terminal N com ácidos graxos permite que peptídeos ou proteínas se ligam às membranas celulares. A sequência Miridamoylated no N-terminal permite que as proteínas da família SRC quinases e as proteínas da transcriptase reversa GAQ sejam direcionadas a se ligarem às membranas celulares. O ácido mirístico estava ligado ao terminal N do polipeptídeo de resina usando reações de acoplamento padrão, e o lipopeptídeo resultante pode ser dissociado em condições padrão e purificado por RP-HPLC.
5. Glicosilação
Glicopeptídeos como vancomicina e teicolanina são antibióticos importantes para o tratamento de infecções bacterianas resistentes a medicamentos, e outros glicopeptídeos são frequentemente usados para estimular o sistema imunológico. Além disso, como muitos antígenos microbianos são glicosilados, é de grande importância estudar glicopeptídeos para melhorar o efeito terapêutico da infecção. Por outro lado, verificou -se que as proteínas na membrana celular das células tumorais exibem glicosilação anormal, o que faz com que os glicopeptídeos desempenhem um papel importante na pesquisa de defesa imune do câncer e tumor. Os glicopeptídeos são preparados pelo método FMOC/T-BU. Os resíduos glicosilados, como treonina e serina, são frequentemente introduzidos em polipeptídeos por FMOCs ativados por éster de pentafluorofenol para proteger os aminoácidos glicosilados.
6. isoprene
A isopentadienilação ocorre nos resíduos de cisteína na cadeia lateral perto do terminal C. O isopreno da proteína pode melhorar a afinidade da membrana celular e formar a interação proteína-proteína. As proteínas isopentadienadas incluem tirosina fosfatase, pequena GTase, moléculas de cochaperna, lâmina nuclear e proteínas de ligação centromérica. Os polipeptídeos de isopreno podem ser preparados usando isopreno em resinas ou introduzindo derivados de cisteína.
7. Modificação de polietileno glicol (PEG)
A modificação do PEG pode ser usada para melhorar a estabilidade hidrolítica da proteína, a biodistribuição e a solubilidade do peptídeo. A introdução de cadeias PEG nos peptídeos pode melhorar suas propriedades farmacológicas e também inibir a hidrólise dos peptídeos por enzimas proteolíticas. Os peptídeos PEG passam pela seção transversal capilar glomerular mais facilmente do que os peptídeos comuns, reduzindo bastante a depuração renal. Devido à meia-vida ativa prolongada de peptídeos PEG in vivo, o nível normal de tratamento pode ser mantido com doses mais baixas e medicamentos peptídicos menos frequentes. No entanto, a modificação do PEG também tem efeitos negativos. Grandes quantidades de PEG impedem a enzima degradar o peptídeo e também reduzem a ligação do peptídeo ao receptor alvo. Mas a baixa afinidade dos peptídeos de PEG é geralmente compensada por sua meia-vida farmacocinética mais longa e, ao estar presente no corpo por mais tempo, os peptídeos PEG têm maior probabilidade de ser absorvido nos tecidos alvo. Portanto, as especificações do polímero PEG devem ser otimizadas para obter melhores resultados. Por outro lado, os peptídeos PEG se acumulam no fígado devido à redução da depuração renal, resultando em síndrome macromolecular. Portanto, as modificações do PEG precisam ser projetadas com mais cuidado quando os peptídeos são usados para testes de drogas.

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hydrazide, alkyne-alkyne, O -toluenesulfonato -Ots, succinimida succinato -Ss, etc. Os derivados de PEG com ácidos carboxílicos podem ser acoplados a aminas N -terminais ou cadeias laterais da lisina. O PEG ativado por amino pode ser acoplado às cadeias laterais de ácido aspártico ou ácido glutâmico. O PEG de Mal ativado pode ser conjugado ao mercaptano de cadeias laterais de cisteína totalmente desprotegidas [11]. Os modificadores de PEG são comumente classificados da seguinte forma (Nota: MPEG é metoxi-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) modificador de pino de cadeia reta
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ADD, MPEG-BUTYRALD, MPEG-SS
(2) modificador de pino bifuncional
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) modificador de pino de ramificação
(MPEG) 2-NHS, (MPEG) 2-ADD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinização
A biotina pode ser fortemente ligada a avidina ou estreptavidina, e a força de ligação é ainda próxima da ligação covalente. Os peptídeos marcados com biotina são comumente usados em imunoensaio, histocitoquímica e citometria de fluxo baseada em fluorescência. Os anticorpos de antibiotina marcados também podem ser usados para ligar peptídeos biotinilados. Os rótulos de biotina são frequentemente presos à cadeia lateral da lisina ou ao terminal N. O ácido 6-aminocaproico é frequentemente usado como uma ligação entre peptídeos e biotina. A ligação é flexível na ligação ao substrato e se liga melhor na presença de impedimento estérico.
9. Rotulagem fluorescente
A marcação fluorescente pode ser usada para rastrear polipeptídeos em células vivas e estudar enzimas e mecanismos de ação. O triptofano (TRP) é fluorescente, para que possa ser usado para rotulagem intrínseca. O espectro de emissão de triptofano depende do ambiente periférico e diminui com a diminuição da polaridade do solvente, uma propriedade útil para detectar a estrutura do peptídeo e a ligação do receptor. A fluorescência do triptofano pode ser extinta por ácido aspártico protonado e ácido glutâmico, o que pode limitar seu uso. O grupo de cloreto de dansil (Dansil) é altamente fluorescente quando ligado a um grupo amino e é frequentemente usado como um rótulo fluorescente para aminoácidos ou proteínas.
A conversão de energia de ressonância de fluorescência (FRET) é útil para estudos de enzimas. Quando o FRET é aplicado, o polipeptídeo do substrato geralmente contém um grupo de etiqueta por fluorescência e um grupo de imersão em fluorescência. Grupos fluorescentes rotulados são extintos pelo extinto através da transferência de energia não fóton. Quando o peptídeo é dissociado da enzima em questão, o grupo de rotulagem emite fluorescência.
10. Polipeptídeos da gaiola
Os peptídeos de gaiola têm grupos de proteção opticamente removíveis que protegem o peptídeo da ligação ao receptor. Quando exposto à radiação UV, o peptídeo é ativado, restaurando sua afinidade com o receptor. Como essa ativação óptica pode ser controlada de acordo com o tempo, a amplitude ou a localização, os peptídeos de gaiola podem ser usados para estudar reações que ocorrem nas células. Os grupos de proteção mais usados para polipeptídeos da gaiola são os grupos 2-nitrobenzil e seus derivados, que podem ser introduzidos na síntese de peptídeos por meio de derivados protetores de aminoácidos. Os derivados de aminoácidos desenvolvidos são lisina, cisteína, serina e tirosina. Os derivados de aspartato e glutamato, no entanto, não são comumente usados devido à sua suscetibilidade à ciclização durante a síntese e dissociação de peptídeos.
11. Peptídeo poliantigênico (mapa)
Os peptídeos curtos geralmente não são imunes e devem ser acoplados a proteínas transportadoras para produzir anticorpos. O peptídeo poliantigênico (MAP) é composto por múltiplos peptídeos idênticos conectados aos núcleos de lisina, que podem expressar especificamente imunógenos de alta potência e podem ser usados para preparar dísticos de proteínas portador de peptídeos. Os polipeptídeos de mapa podem ser sintetizados por síntese de fase sólida na resina do mapa. No entanto, o acoplamento incompleto resulta em cadeias peptídicas ausentes ou truncadas em alguns ramos e, portanto, não exibe as propriedades do polipeptídeo do mapa original. Como alternativa, os peptídeos podem ser preparados e purificados separadamente e depois acoplados ao mapeamento. A sequência peptídica ligada ao núcleo do peptídeo é bem definida e facilmente caracterizada por espectrometria de massa.
Conclusão
A modificação do peptídeo é um meio importante de projetar peptídeos. Os peptídeos quimicamente modificados podem não apenas manter a alta atividade biológica, mas também evitar efetivamente as desvantagens da imunogenicidade e da toxicidade. Ao mesmo tempo, a modificação química pode dotar peptídeos com algumas novas propriedades excelentes. Nos últimos anos, o método de ativação de C-H para a pós-modificação de polipeptídeos foi rapidamente desenvolvido e muitos resultados importantes foram alcançados.
Hora de postagem: 2025-07-03
