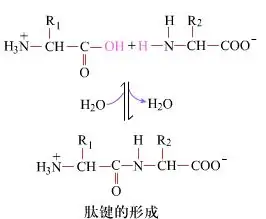
Na superfície, a formação de ligações peptídicas, produzindo dipeptídeos, é um processo químico simples. Isso significa que os dois componentes de aminoácidos estão ligados por uma ligação peptídica, uma ligação amida, enquanto são desidratados.
A formação de ligação peptídica é a ativação de um aminoácido em condições leves de reação. (A) Porra de carboxil, segundo aminoácido (b) A porção carboxil ativada nucleofílica forma o dipeptídeo (A-B). "Se o componente carboxila (A) não estiver protegido, a formação da ligação peptídica não poderá ser controlada." Os subprodutos como peptídeos lineares e cíclicos podem ser misturados com compostos alvo a-b. Portanto, todos os grupos funcionais não envolvidos na formação de ligações peptídicas devem ser protegidos de maneira temporariamente reversível durante a síntese de peptídeos.
Portanto, a síntese de peptídeos - a formação de cada ligação peptídica - envolve três etapas de agregação.
O primeiro passo é preparar alguns aminoácidos que precisam de proteção e a estrutura zwitteriônica dos aminoácidos não existe mais.
A segunda etapa é uma reação em duas etapas para formar ligações peptídicas, na qual o grupo carboxila do aminoácido protegido por N é primeiro ativado para o intermediário ativo e, em seguida, a ligação peptídica é formada. Essa reação acoplada pode ocorrer como uma reação de uma etapa ou como duas reações seqüenciais.
A terceira etapa é a remoção seletiva ou a remoção completa da base de proteção. Embora toda a remoção só possa ocorrer após a montagem de todas as cadeias peptídicas, também é necessária a remoção seletiva de grupos de proteção para continuar a síntese de peptídeos.
Como 10 aminoácidos (Ser, Thr, Tyr, ASP, Glu, Lys, Arg, His, Sec e Cys) contêm grupos funcionais da cadeia lateral, que requerem proteção seletiva, tornando a síntese de peptídeos mais complicada. As bases de proteção temporária e semi-permanente devem ser distinguidas devido aos diferentes requisitos de seletividade. Grupos de proteção temporária são usados na próxima etapa para refletir a proteção temporária dos grupos funcionais de aminoácidos ou carboxila. Grupos de proteção semi-permanentes são removidos sem interferir em ligações peptídicas já formadas ou cadeias laterais de aminoácidos, às vezes durante a síntese.
"Idealmente, a ativação do componente carboxil e a subsequente formação de ligações peptídicas (reações de acoplamento) devem ser rápidas, sem formação racêmica ou subproduct, e os reagentes molares devem ser aplicados para obter altos rendimentos". Infelizmente, nenhum dos métodos de acoplamento químico satisfaz esses requisitos e poucos são adequados para a síntese prática.
Durante a síntese de peptídeos, os grupos funcionais envolvidos em várias reações geralmente estão ligados ao centro manual, sendo a glicina a única exceção, e há um risco potencial de rotação.
A etapa final no ciclo de síntese de peptídeos é a remoção de todos os grupos de proteção. A remoção seletiva de grupos de proteção é importante para a extensão da cadeia peptídica, além da exigência de remoção completa da proteção na síntese do dipeptídeo. As estratégias sintéticas devem ser cuidadosamente planejadas. Dependendo da escolha estratégica, N pode remover seletivamente os grupos de proteção α-amino ou carboxila. O termo "estratégia" refere -se à sequência de reações de condensação de aminoácidos individuais. Em geral, há uma diferença entre síntese gradual e condensação de fragmentos. A síntese de peptídeos (também conhecida como "síntese convencional") ocorre em solução. Na maioria dos casos, o alongamento gradual da cadeia peptídica só pode ser sintetizado usando a cadeia peptídica para sintetizar fragmentos mais curtos. Para sintetizar peptídeos mais longos, as moléculas alvo devem ser segmentadas em fragmentos apropriados e determinados que podem minimizar o grau de diferenciação no terminal C. Depois que os fragmentos individuais são gradualmente montados, o composto alvo será unido. A estratégia de síntese de peptídeos inclui a seleção do melhor e mais apropriado fragmento protetor, e a estratégia de síntese de peptídeos inclui a seleção da combinação mais apropriada de bases protetoras e o melhor método de conjugação de fragmentos.
Horário de postagem: 2025-07-02